
Witte bloedcellen in transparante embryo’s
Leidse moleculair-celbiologen in de onderzoeksgroep van Annemarie Meijer hebben nieuwe genen ontdekt die specifiek tot expressie komen tijdens de vroege ontwikkeling van macrofagen in de zebravis, waaronder een signaaleiwit dat essentieel is voor de migratie van macrofagen tijdens de immuunreactie op een bacteriële infectie. Hun resultaten werden gepubliceerd op 27 April in het toonaangevende medische tijdschrift Blood, met postdoc Anna Zakrzewska en promovendus Chao Cui als gedeelde eerste auteurs van het artikel.
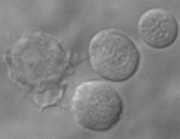
Macrofaag (links) naast drie rode bloedcellen in een 1 dag oud zebravisembryo, waargenomen met contrastmicroscopie.
Macrofagen zijn witte bloedcellen die cruciaal zijn voor de immuunreactie op microbiële infecties. Macrofagen migreren snel naar een plaats van infectie, waar ze op een efficiënte manier bacteriën of andere microorganismen in zich kunnen opnemen en vernietigen. Hun taak is ook om het lichaam te zuiveren van celresten en van beschadigde of verouderde cellen. In alle gewervelde dieren wordt de ontwikkeling van macrofagen en andere witte bloedcellen gestuurd door een transcriptiefactor die bekend staat als Spi1 of Pu.1. Echter, ondanks dat Spi1 uitgebreid is onderzocht, is het nog grotendeels onbekend welke gengroepen precies door deze essentiële transcriptiefactor worden gereguleerd.
Het zebravismodel
Om immuungenen te identificeren die afhankelijk zijn van de essentiële transcriptiefactor Spi1, maakte de Leidse groep gebruik van het zebravisembryomodel. Zebravisembryo’s bezitten al in het begin van hun ontwikkeling een aangeboren immuunsysteem. Het feit dat de embryo’s optisch transparant zijn, maakt ze bij uitstek geschikt voor het bestuderen van de ontwikkeling en functie van de vroege immuuncellen. Bovendien bestaan er zeer efficiënte technieken om genfuncties uit te schakelen en te bestuderen in het zebravisembryomodel.
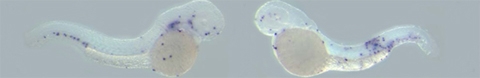
Visualisatie van immuuncellen in optisch transparante zebravisembryo’s. In het embryo rechts, is de migratie van immuuncellen naar een plaats van infectie opgewekt door een lokale injectie van bacteriën in het spierweefsel van de staart. Links wordt een ongeïnfecteerd embryo getoond.
Ontdekking van genen
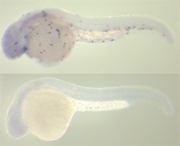
Uitschakeling van de transcriptiefactor Spi1 leidt tot embryo’s die geen immuuncellen maken (onder) in vergelijking met 1 dag oude controle-embryo’s (boven).
Om nieuwe merkers van macrofagen in de zebravis te ontdekken, werd een microarraystrategie toegepast. Deze techniek maakt het mogelijk om de expressie van vele duizenden genen tegelijk te onderzoeken. Genexpressie in controle-embryo’s werd vergeleken met genexpressie in embryo’s die geen macrofagen bezaten doordat de Spi1-transcriptiefactor, noodzakeliijk voor macrofaagontwikkeling, genetisch was uitgeschakeld. Daarnaast werd een transgene zebravislijn gebruikt, waarin de precursorcellen van de macrofagen gemarkeerd waren met het groen-fluorescente eiwit, GFP. De GFP-positieve cellen werden geïsoleerd uit embryo’s van deze transgene lijn door middel van de zogenoemde FACS-techniek (Fluorescence Activated Cell Sorting). Vervolgens werd de overlap bepaald tussen de genen waarvan de expressie verlaagd was na uitschakeling van Spi1 en de genen die een verrijkt expressieniveau hadden in de GFP-positieve celfractie. Zodoende kon een grote set van Spi1-afhankelijke genen geïdentificeerd worden die tot expressie komen in de cellen van het immuunsysteem van het embryo.
Expressiepatronen
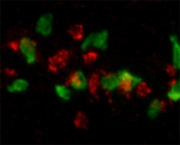
Fluorescente in-situ-hybridisatietechniek om specifieke expressie in macrofagen (rood) en neutrofielen (groen) te onderscheiden.
De groep van geïdentificeerde genen bevatte verschillende bekende genen met functies bij de ontwikkeling van bloedcellen en het immuunsysteem, maar ook nieuwe genen met immuun-gerelateerde functies. De volgende stap was om de specificiteit van de expressie van deze genen te bepalen in verschillende celtypen van het immuunsysteem, zoals macrofagen en neutrofielen. Door middel van fluorescente co-lokalisatie-experimenten met bekende merkers van deze celtypen, konden verschillende nieuwe genen aangetoond worden die specifiek tot expressie komen tijdens de vroege ontwikkeling van macrofagen. Deze genen worden nu gebruikt om nieuwe transgene lijnen te maken waarmee het mogelijk wordt om de functie van macrofagen in levende embryo’s te bestuderen door middel van ‘real-time’ fluorescentiemicroscopie.
Celmigratie naar infecties
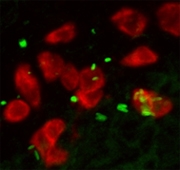
Opeenhoping van macrofagen (rood) rond een infectie van Salmonella-bacteriën (groen).
Eén van de vroege macrofaag-specifieke genen codeert voor een chemokinereceptor, genaamd cxcr3.2. Chemokinereceptoren zijn signaaleiwitten die chemokinen detecteren. Dat zijn kleine eiwitten die worden uitgescheiden en de migratie van immuuncellen kunnen aantrekken. Om de functie te bestuderen, werd de expressie van de chemokinereceptor in zebravisembryo’s genetisch uitgeschakeld. Vervolgens werden Salmonella-bacteriën lokaal geïnjecteerd in het spierweefsel van de staart van deze embryo’s. Deze experimenten lieten zien dat cxcr3.2 een belangrijke rol speelt bij de migratie van macrofagen tijdens de immuunreactie van zebravisembryo’s op een bacteriële infectie.
Links
- Het artikel Macrophage-specific gene functions in Spi1-directed innate immunity.Blood. 2010 Apr 27. [Epub ahead of print].
