
Opruimactie tegen tuberculose en salmonella-infecties
Het eigen cellulaire recyclesysteem van zebravissen kan schadelijke bacteriën opeten en zo weerstand bieden tegen infecties als tuberculose en salmonellose. Dat schrijven Leidse biologen van de groep van Annemarie Meijer. Het stimuleren van deze vorm van afweer kan gebruikt worden in nieuwe behandelmethoden tegen infectieziekten. De onderzoekers publiceren hun resultaten in twee toonaangevende vakbladen, Autophagy en PLOS Pathogens.
Bacteriën opeten
Enkele van de gevaarlijkste infectieziekten in de wereld worden veroorzaakt door bacteriën die zich vermeerderen in cellen van het immuunsysteem, voornamelijk in zogeheten macrofagen. Het is al bekend dat macrofagen zich kunnen verdedigen door deze ziekteverwekkers op te eten. Deze reactie staat bekend als autofagie, wat letterlijk betekent: ‘het eten van zichzelf’. In gezonde organismen functioneert dit als een recyclingsysteem om ongewenste en beschadigde componenten van cellen op te ruimen. Maar, tijdens een immuunrespons wordt dit systeem gebruikt om microbiële indringers te vangen en af te breken. Het stimuleren van deze autofagie-afweer is daarom een mogelijke nieuwe behandelingsstrategie voor infectieziektes. Het nieuwe onderzoek van Meijer en haar collega’s in zebravismodellen voor tuberculose en salmonellose ondersteunt deze gedachte.
Tuberculose
Het onderzoek in PLOS Pathogens gaat over indringers uit de familie van mycobacteriën. Verschillende soorten mycobacteriën veroorzaken tuberculose in mensen en vissen. Ze kunnen zich vermeerderen in blaasjes in geïnfecteerde macrofagen, maar ze kunnen ook ontsnappen naar een ander deel van de cel, het cytoplasma. Hier worden ze het doelwit van de autofagie-afweer. Dit brachten de Leidse biologen in beeld door middel van geavanceerde microscopie en fluorescerende autofagie-eiwitten in larven van de zebravis. Hieruit bleek dat twee autofagie-receptoren in zebravissen, p62 en Optineurin, beide nodig zijn voor de afweer tegen de ontsnappende bacteriën.
Dit werkt als volgt: ontsnapte bacteriën worden in het cytoplasma gemarkeerd met de signaalstof ubiquitine. De receptoren herkennen dit signaal, en pikken een bacterie op. Vervolgens kunnen ze die afleveren aan de autofagiemachinerie. ‘Het bleek dat vissen zonder de receptoren veel bevattelijker zijn voor infectie,’ legt Meijer uit. ‘Vissen die juist meer p62 of Optineurin maken, bleken beter resistent tegen infectie.’
Salmonellose
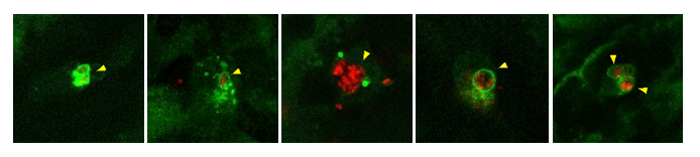
In het tijdschrift Autophagy richten de onderzoekers zich op salmonella. Verschillende varianten van Salmonella enterica veroorzaken maag-darm-infecties (salmonellose) of ernstiger lichamelijke infecties, zoals buiktyfus. Bij deze ziekteverwekkers ontdekten de onderzoekers nog iets anders. Ze zagen dat blaasjes met salmonella worden gemarkeerd door een eiwit van de autofagie-machinerie, genaamd Lc3 Dit gebeurt kort nadat de bacteriën zijn opgenomen door macrofagen. ‘Je ziet als het ware een ring van Lc3 rondom de bacteriën’, vertelt Meijer. ‘We denken dat dit helpt om de ontsnapping van de bacteriën tegen te gaan en dat het de fusie met verteringsblaasjes bevordert.’ Het markeren van geïnfecteerde blaasjes wordt LAP genoemd: Lc3-associated phagocytosis. De resultaten tonen aan dat LAP een belangrijk beschermend mechanisme is voor de afweer van macrofagen tegen salmonella tijdens een infectie.
Anti-infectie
De resultaten van beide studies zijn een aanmoediging voor verder onderzoek naar de autofagie-afweer. Meijer: ‘Door deze vorm van afweer te stimuleren, zouden we infecties kunnen behandelen die resistent zijn tegen antibiotica. Dit kan met behulp van medicijnen die aangrijpen op eiwitten die het autofagieproces harder kunnen aanzetten.’
