
Twee cum laude promoties voor opslaan duurzame energie
Zowel Leon Jacobse als Thom Hersbach uit de onderzoeksgroep van Marc Koper zijn cum laude gepromoveerd. Ze onderzochten allebei veranderingen aan het oppervlak van een platina-elektrode. Jacobse deed dat bij een positieve spanning, Hersbach bij een negatieve. Platina heeft de potentie om duurzaam opgewekte energie met behulp van water om te zetten in waterstof, dat vervolgens als brandstof kan dienen.
Duurzame energie opslaan als waterstof
Duurzaam opgewekte energie zoals zonne- en windenergie is niet altijd beschikbaar op de juiste plek en op het juiste moment. Om toch altijd en overal te kunnen beschikken over duurzame energie, is het belangrijk dat er manieren komen om die energie op te slaan. En daar kan elektrolyse bij helpen: met elektrolyse kunnen water en duurzame elektriciteit omgezet worden in waterstof en zuurstof. De energie die opgeslagen zit in waterstof kan vervolgens gebruikt worden, bijvoorbeeld door middel van een brandstofcel in een waterstofauto. Bij beide reacties speelt platina een belangrijke rol.
Platina nog onbegrepen
Ondanks dat platina veelvuldig wordt gebruikt – zoals in de uitlaat van de huidige auto’s – begrijpt men nog steeds niet precies hoe het zich gedraagt. Zowel Jacobse als Hersbach hebben tijdens hun promotie fundamenteel onderzoek gedaan, met als voornamelijk doel het elektrochemisch (zie kader) gedrag van platina beter te leren begrijpen. Ze hebben beiden structuurveranderingen aan platina-elektroden bestudeerd en de effecten die die veranderingen hebben op de reactiviteit van deze elektroden.

Vastgeroest onderzoek
‘Ik heb onderzocht hoe een platina-oppervlak aangetast wordt door oxidatie bij een positieve spanning’, zegt Jacobse. Oxidatie is hetzelfde proces als het roesten van je fiets. ‘Uit de literatuur was al bekend dat deze oxidatie de reactiviteit van platina verandert, maar hoe de reactiviteit en de structuur van het oppervlak tot elkaar relateren was nog onbekend.’ Jacobse maakte hiervoor gebruik van zogeheten Electrochemical Scanning Tunneling Microscopy. Hierbij scant een naald van slechts een paar atomen dik het platina-oppervlak. ‘Uniek aan ons experiment is dat we dit in een elektrochemische cel gedaan hebben’, zegt hij. ‘Alleen zo was het mogelijk de veranderingen in de structuur stap voor stap te volgen én direct te relateren aan de reactiviteit die we in hetzelfde experiment hebben gemeten.'

Opnemen van elektronen
‘Ik heb mij gericht op de zogeheten kathodische corrosie’, zegt Hersbach. ‘Dit is de corrosie van metalen zoals platina die niet bij een positieve spanning plaatsvindt, zoals bij Leon, maar bij een negatieve spanning. Een nog onbegrepen fenomeen, waar wereldwijd maar een handjevol mensen aan werkt. Een veld waar dus veel nieuwe kennis te halen valt.’ Zo ontdekte Hersbach dat kathodische corrosie al bij een veel lagere spanning plaatsvindt dan werd gedacht. En dat betekent dat kathodische corrosie waarschijnlijk veel meer reacties beïnvloedt dan men vermoedde. ‘Daarnaast heb ik aangetoond dat kathodische corrosie de katalytische activiteit van platina kan verbeteren voor de omzetting van zuurstof naar water, een belangrijke reactie in brandstofcellen.’
Inmiddels hebben beide scheikundigen een postdocpositie gevonden. Jacobse werkt sinds december bij German Electron Synchrotron (DESY) in Hamburg, Hersbach begint in februari bij de Universiteit van Texas in Austin, Amerika.
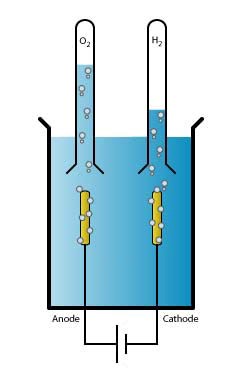
Elektrochemie is het vakgebied dat zich richt op de relatie tussen elektriciteit en chemie. Zo valt bijvoorbeeld de omzetting van energie in batterijen onder elektrochemie. Het simpelste voorbeeld is de elektrolyse van water, waarbij zuurstof en waterstof gevormd worden – precies de reactie waar de groep van Marc Koper zich op richt. Hierbij zijn er twee elektroden die stroom door het water sturen: de positief geladen anode en de negatief geladen kathode. Het water splitst zich in een evenwichtsreactie in een waterstofion (H+, oftewel een proton) en een hydroxide-ion (OH-). Aan de kathode wordt waterstof gevormd, door de reactie van vier protonen met vier elektronen. Aan de anode vormt zich water en zuurstof uit hydroxide-ionen.
|
Watersplitsing: |
H2O |
↔ |
H+ + OH− |
|
Kathode: |
4 H+ + 4 e− |
→ |
2 H2 |
|
Anode: |
4 OH− |
→ |
2 H2O + O2 + 4 e− |
