
De speurtocht naar meer antibiotica
Streptomyceten lijken op schimmels, maar het zijn bacteriën die in de grond leven. Ze zijn erg populair in de biotechnologie omdat ze veel antibiotica en enzymen produceren. Met zijn Vici-project gaat de Leidse onderzoeker Gilles van Wezel manieren zoeken om die productie te verhogen.
Het bijzondere aan dit Vici-project is’, zegt Van Wezel, ‘dat het wordt gefinancierd door de Stichting Toegepaste Wetenschappen (STW). Het is voor het eerst dat Leiden als ‘gewone’ universiteit zo’n subsidie, die doorgaans naar de technische universiteiten gaat, in de wacht sleept. Het illustreert ook dat ik me richt op de bio_technologie_.’ Van Wezels Vici-project is een voorbeeld van hoe fundamenteel en toegepast werk hand in hand kunnen gaan.
Celdeling
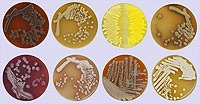
Streptomyceten produceren naast antibiotica een breed scala aan nuttige enzymen, gebruikt in onder meer de wasmiddelen- en voedingsindustrie. Deze grondbacteriën zijn als exotisch organisme bij uitstek geschikt om de celdeling te bestuderen. De vermeerdering en deling van cellen is een complex proces. ‘Streptomyceten zijn de enige organismen, waarin celdeling niet essentieel is, zodat hierbij gemakkelijk mutanten gemaakt en bestudeerd kunnen worden’, zegt Van Wezel. Naast deze fundamentele heeft hij ook een praktische reden om de celdeling bij streptomyceten te bestuderen, namelijk de verbetering van de groei in fermentoren (groeivat voor micro-organismen).
Moleculaire schakelaar
Streptomyceten hebben een complexe levenscyclus die erg lijkt op die van draadvormende (filamenteuze) schimmels, zoals de schimmel die penicilline levert. Na de ontkieming van een spore ontstaat in de grond een dradennetwerk, het mycelium. Zodra het voedsel in de bodem opraakt, wordt een luchtmycelium gevormd, dat er wit en donzig uitziet. Het luchtmycelium vormt sporen, die resistent zijn tegen hitte en uitdroging en die weer verspreid worden. Tijdens de ontwikkeling kannibaliseert de streptomyceet zijn eigen mycelium om aan de nodige bouwstoffen te komen. Omdat op dat moment in de bodem geen voedingsstoffen meer aanwezig zijn trekt dat andere bacteriën aan en vermoedelijk worden juist dan antibiotica geproduceerd om ongewenste gasten buiten de deur te houden.
Signaalmolecuul
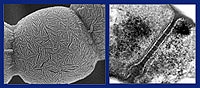
Vorig jaar nog hebben Van Wezel c.s. het mechanisme opgehelderd dat ervoor zorgt dat de antibioticumproductie in streptomyceten wordt aangezet. Een signaalmolecuul speelt hierbij een cruciale rol. Dit molecuul inactiveert het regulatie-eiwit DasR, dat de antibioticumproductie onderdrukt. Als DasR niet actief is, ligt de weg naar productie helemaal open. Van Wezel: ‘We kunnen de antibioticumproductie met behulp van een moleculaire schakelaar aanzetten door het signaalmolecuul toe te voegen aan een kweekmedium. Wat vooral erg interessant is, is dat ook veel antibiotica die we normaal niet zien opeens zichtbaar worden.’
Goudmijn
Het is duidelijk dat deze ontdekking een goudmijn vormt in een tijd waarin de behoefte aan nieuwe antibiotica net zo actueel is als zestig jaar geleden. De dalende trend in het ontdekken van nieuwe antibiotica is een groot probleem voor de wereldgezondheid. Van Wezel coördineert ook een ander door STW gefinancierd project waarin samen met andere Leidse wetenschappers als Erik Vijgenboom, Hermen Overkleeft, Mark Overhand, Rob Verpoorte en Young Choi actief gespeurd wordt naar verborgen antibioticumclusters, de antibiotica van de toekomst dus.
Knock-outmutanten
In zijn eigen Vici-project staat dus de celdeling in relatie tot de groei van streptomyceten centraal. In de vorming van celwandmateriaal is het SsgA-eiwit cruciaal. Alle streptomyceten hebben meerdere SsgA-achtige eiwitten (SALPs). Van Wezel: ‘We hebben recentelijk stammen gemaakt die de informatie voor één van de eiwitten missen, de zogenoemde knock-outmutanten. Het blijkt dat SALPs zonder uitzondering een rol spelen bij de celdeling, van stimulering van de celdeling tot aan het scheiden van de rijpe sporen.’
Gepatenteerde technologie

De basis van dit onderzoek is al eind 1996 gelegd met het verzoek van DSM-Delft om te proberen streptomyceten meer gefragmenteerd te laten groeien. In de fermentor vormen streptomyceten veelal eindeloos lange hyfen (de draden die samen het mycelium vormen) en dichte netwerken van in elkaar verweven hyfen. Van Wezel: ‘Deze groeivorm is zeer ongunstig voor een grote productieschaal. De grote myceliumklonten leiden tot trage groei met een te lage opbrengst als resultaat. SsgA heeft een sterke invloed op de groei, hoe meer SsgA hoe meer celdeling en fragmentatie. Dit maakt het mogelijk om de groei genetisch te beïnvloeden en met behulp van een aantal genetische tools als het ware achter de knoppen te zitten.’ Deze gepatenteerde technologie blijkt tot een aanmerkelijke rendementsverbetering te leiden.
‘Black box’-benadering
‘We hebben inmiddels een aantal stappen in de goede richting gezet, maar we stuitten toch op een nieuw probleem: de relatie tussen groei en antibioticumproductie. Veel antibiotica hebben een minimum klontgrootte nodig voordat er iets gemaakt kan worden, terwijl andere antibiotica en veel enzymen juist baat hebben bij heel kleine fragmenten. Dit fenomeen is eigenlijk nog nooit onderzocht. Doorgaans geeft de industrie er de voorkeur aan om productiestammen via een ‘black box’-benadering te optimaliseren. Niemand weet dan ook waar in streptomyceten de producten gemaakt en uitgescheiden worden. Is dit aan de uiteinden, waar de groei plaatsvindt, of juist in het midden langs de wand van de hyfen? Inzicht hierin is noodzakelijk, omdat het alleen dan mogelijk wordt om te komen tot gerichte stamverbetering.’
Continuïteit
In Van Wezels Vici-project, dat ondersteund wordt door DSM en Danisco-Genencor, staan drie onderzoekslijnen centraal. Het analyseren waar productie en afscheiding plaatsvinden en hoe deze reageren op groeicondities, bepalen hoe de activiteit van de sleutelgenen afhangt van groei en groeisnelheid en een voorspellend computermodel bouwen waarin alle data worden geïntegreerd, in samenwerking met Mark van Loosdrecht en Christian Picioreanu van de TU Delft, zodat als het ware een digitale testrun van een fermentatie gedraaid kan worden en veel gerichter processen kunnen worden gestuurd en verbeterd. Verder gaat hij innovatieve technologie voor genetische manipulatie van streptomyceten ontwikkelen. Van Wezel: ‘Juist door de tweeledigheid (fundamenteel en toegepast) is intensieve samenwerking tussen de TU Delft en de Universiteit Leiden van groot belang voor de continuïteit van dit type onderzoek.’
