
Leidse onderzoekers brengen eiwit in beeld met hoogste resolutie ooit
Nog nooit was een kristalstructuur van een menselijk eiwitmolecuul in een celwand zo kristalhelder. De Leidse onderzoekers Ad IJzerman en Laura Heitman maakten samen met Amerikaanse collega’s de meest gedetailleerde kristalstructuur ooit van een doeleiwit voor geneesmiddelen. De onderzoekers publiceerden hun resultaat in het blad Science.
Receptor
Het gaat om de adenosine A2A-receptor, de belangrijkste receptor voor cafeïne in het lichaam. Deze wordt in verband gebracht met de ziekte van Parkinson. De klasse van ca. 800 eiwitten waartoe de adenosine A2A-receptor behoort, vormt het aangrijpingspunt voor ongeveer de helft van alle medicijnen. ‘Geen wonder dat onderzoekers over de hele wereld al tientallen jaren bezig zijn te ontdekken hoe ze eruit zien’, zegt IJzerman.
Kristalliseren
Om erachter te komen of medicijnen werken moet je weten hoe de receptoren in de celwand in elkaar zitten. Een belangrijke manier om dat te doen is het eiwit kristalliseren, zodat het met röntgenstralen bekeken kan worden. In 2008 wisten IJzerman en zijn onderzoeksteam de kristalstructuur al te bepalen van de adenosine A2A-receptor, maar met een minder hoge resolutie. IJzerman: ‘Sindsdien is een handvol structuren van andere receptoren in de wetenschappelijke literatuur verschenen, maar met een dusdanig lage resolutie dat het in sommige gevallen zelfs moeilijk te bepalen was hoe medicijnen zich aan zo’n receptor binden.’ Heitman vult aan: ‘Met onze nieuwe structuur hebben we een eiwit in de menselijke celwand met de hoogste resolutie ooit in beeld gebracht.’

Mysterie opgelost
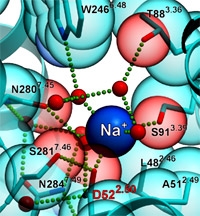
De mate van detaillering van de nieuwe hoge resolutie kristalstructuur maakt dingen zichtbaar die voorheen onzichtbaar waren. ‘Vergelijk wat Galileo zag met zijn sterrenkijker met de afbeeldingen die de Hubble telescoop maakt’, zegt IJzerman. Zo is te zien hoe watermoleculen een wezenlijke rol spelen bij de activering van de adenosine A2A-receptor. Een waterkanaaltje in de inactieve receptor blijkt daarbij te worden verstoord. De teams ontdekten bovendien een verborgen plekje met daarin een natrium-ion, buiten de medicijnbindende holte van de receptor. Dat geeft inzicht in de manier waarop natrium-ionen de werking van hormonen en neurotransmitters in het lichaam beïnvloeden, iets wat tot nu toe een mysterie was.

Slimme strategie
De hoge resolutie-structuur was het resultaat van een slimme strategie van de samenwerkingspartners bij het Scripps Institute in La Jolla (Californië). Door het receptoreiwit, dat vettig is en daardoor moeilijk kristalliseert, te koppelen aan een ander eiwit dat dit wel kan, slaagden de onderzoekers erin om minuscule kristallen te produceren. Voorheen gebruikten ze het eiwit lysozyme voor dit proces, maar nu deden ze het met eiwitten die nog makkelijker kristalliseren en nog beter passen op de receptor. Dit leverde uiteindelijk de structuur met hoge resolutie op die zo veel meer vertelt dan elke andere structuur die in het verleden van een receptor gemaakt is.
Cafeïne en Parkinson
Uit onderzoek is gebleken dat koffiedrinkers minder vaak aan de ziekte van Parkinson lijden. Cafeïne blokkeert de adenosine A2A-receptor, die wordt geassocieerd met de aandoening. Ook bij ontstekingen speelt deze receptor een cruciale rol.
Artikel
Liu W, Chun E, Thompson AA, Chubukov P, Xu F, Katritch V, Han GW, Roth CB, Heitman LH, IJzerman AP, Cherezov V, Stevens RC.
Structural Basis for Allosteric Regulation of GPCRs by Sodium Ions
Verschijnt in Science op 13 juli 2012.
Zie ook
Nieuwsartikel: Koffie en de ziekte van Parkinson (oktober 2008)
