Onderzoeksproject
Klassieke conditionering om immunotherapie bij kanker te verbeteren
Kan het conditioneringsparadigma worden gebruikt voor kankerbehandeling met checkpointinhibitie?
- Looptijd
- 2022
- Contact
- Chiara Jongerius
- Financiering
-
 KWF, Unique High Risk project
KWF, Unique High Risk project
Immunotherapie is een doorbraak in de behandeling van kanker. Immunotherapie activeert iemands eigen immuunsysteem om kanker te bestrijden. Checkpointremming is de meest gebruikte immuuntherapie voor kanker en is goedgekeurd voor de behandeling van meerdere soorten maligniteiten. Patiënten met verschillende soorten kanker hebben baat bij de behandeling met immuuncheckpointremming.
Immuuncheckpointremmers reguleren de activiteit van T-cellen om tumorceldood door T-cellen te bevorderen. Checkpointremming van T-cellen kan echter ook toxische bijwerkingen veroorzaken in onder andere het maagdarmkanaal, de hersenen, de schildklier, de longen en de huid. Bovendien is het gebruik van checkpointremming door de hoge kosten van remmers vaak niet kosteneffectief in vergelijking met bijvoorbeeld chemotherapie. Daarom zijn er inspanningen nodig om immunotherapie te verbeteren, te ondersteunen en de effecten ervan te vergroten.
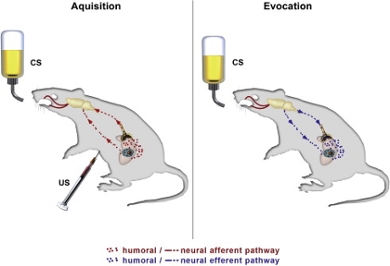
Een geconditioneerde immuunreactie uitlokken
We willen testen of immunotherapie kan worden ondersteund door een geconditioneerde immuunrespons. Een geconditioneerde immuunreactie zou de werkzaamheid van de behandeling kunnen verbeteren en de hoge kosten van immunotherapie voor de gezondheidszorg kunnen verlagen. Een geconditioneerde immuunreactie kan worden opgeroepen door klassieke conditionering. Het conditioneringsontwerp maakt gebruik van een geconditioneerde stimulus, wat een aanvankelijk neutrale stimulus is (een smaak of geur). Immuunfuncties worden gestimuleerd door deze geconditioneerde stimulus herhaaldelijk te koppelen aan een medicijn dat een immuunreactie veroorzaakt. Wanneer de geconditioneerde stimulus wordt aangeboden zonder het medicijn, vindt de aangeleerde immuunreactie nog steeds plaats. Daarnaast kan het conditioneringsparadigma gebruikt worden om de dosering van medicatie te verlagen, terwijl de effectiviteit van de behandeling verbetert of behouden blijft. Conditionering van de immuunrespons na immuuncheckpointremming in relatie tot de behandeling van kanker is echter nog nooit getest, hoewel het wijdverspreide gevolgen kan hebben voor checkpointremmingstherapie in verschillende kankertypes. Het onderzoeken van de conditionering van immuuncheckpointremming kan ook informatie geven over immuunmechanismen in kankertherapie die toekomstige behandelingen kunnen beïnvloeden. Daarom is het belangrijk om de effecten en mechanismen van conditionering van immuuntherapie voor de behandeling van kanker te onderzoeken.
Wij veronderstellen dat het conditioneringsparadigma een effectieve strategie biedt om de werkzaamheid van immuuntherapie met checkpointinhibitie te verbeteren en de doses voor de behandeling van kanker te verlagen. Daarom willen we testen of conditionering, d.w.z. het herhaaldelijk koppelen van immuunremming met een geconditioneerde stimulus, resulteert in een veranderde immuunrespons. Deze aangeleerde immuunrespons bootst het effect van de medicatie na. We veronderstellen dus dat de geconditioneerde immuunreactie zal bijdragen aan de vermindering van tumorgroei.
Muriene kankermodellen
We willen testen of het conditioneringsparadigma toepasbaar is op checkpointremming in kankermodellen bij muizen. We willen een proof of concept opzetten in muismodellen om de biologische mechanismen achter een gestandaardiseerd protocol aan te tonen.
Met de voorgestelde proefopzet kunnen we onze belangrijkste hypothese bevestigen of verwerpen. We verwachten dat het conditioneringsparadigma de effecten van immunotherapie verbetert, wat brede implicaties zal hebben voor de behandeling van meer kankersoorten. Conditionering heeft de potentie om immuuntherapie effectiever en veiliger te maken op een eenvoudige en niet-invasieve manier, door de dosering van medicijnen te verminderen en de werkzaamheid van de behandeling te behouden. Om de bevindingen bij mensen te valideren, zullen de resultaten van onze experimenten worden vertaald naar toekomstige klinische onderzoeken om de behandeling voor kankerpatiënten te kunnen verbeteren.
