
Is Parkinson te stoppen door eiwitvezels te ontrafelen? Anne Wentink zoekt het uit met een Vidi-subsidie van NWO
beeld: Pixabay
Bij hersenziekten als Parkinson en Alzheimer klonteren eiwitten samen tot vezels. ‘Chaperonne-eiwitten’ ontrafelen die vezels, maar in de reageerbuis zag biochemicus Anne Wentink dat daarmee ook nieuwe problemen kunnen ontstaan. Ze gaat uitzoeken wat er in cellen gebeurt, om erachter te komen wat een medicijn zou moeten doen.

Anne Wentink is gefascineerd door chaperonne-eiwitten. ‘Hun naam verwijst naar de Victoriaanse tijd, waarin welgestelde jongeren altijd begeleid werden door chaperonnes om ze voor misstappen te behoeden. Op een soortgelijke manier begeleiden chaperonne-eiwitten net gevormde eiwitten bij hun ontwikkeling en vouwing. Ook zorgen ze dat ze de juiste 3D-structuur behouden tijdens hun levensduur.’ Andere eiwitten reageren vaak heel specifiek op één bepaalde receptor en doen dan hun ding. Chaperonnes zijn anders. ‘Ze zijn uniek onder de eiwitten, omdat ze zo aspecifiek werken en toch doeltreffend zijn.’
Ook wanneer chaperonne-eiwitten de aan elkaar geklonterde vezels tegenkomen die typisch zijn voor neurodegeneratieve ziekten als Alzheimer, Huntington en Parkinson, komen ze in actie. Ze trekken de vezels uiteen tot de enkele eiwitten en kunnen op deze manier de schadelijke ophopingen tegengaan. Tijdens haar postdoc-onderzoek zagen Wentink en haar collega’s in een reageerbuis wat er gebeurt als chaperonne Hsp70 de eiwitvezels te lijf gaat. ‘We zagen dat de losse fragmenten die ontstaan uit de kapotgetrokken vezels gemakkelijk weer nieuwe vezels vormen. Dat zou de ziekte kunnen versnellen. We vragen ons af of dat ook in cellen gebeurt, of dat daar weer andere mechanismen zijn die dat tegengaan.’
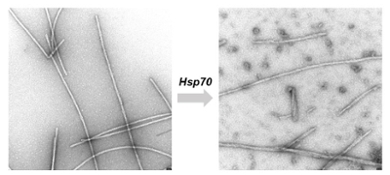
Eerst in een reageerbuis, nu in de cel
De balans tussen positieve en negatieve effecten van Hsp70, daar wil Wentink meer van weten. Met de Vidi-subsidie van NWO verplaatst Wentink haar onderzoek daarom van de reageerbuis naar levende cellen. ‘We maken de eiwitvezels fluorescerend en brengen ze in bij cellen. Vervolgens kijken we hoe het afbraakproces verloopt.’ Dat kijken gebeurt met microscopie en met flowcytometry: een techniek om met laserlicht kleine deeltjes te tellen en te bestuderen in een stromende vloeistof. ‘We manipuleren de hoeveelheid Hsp70-chaperonne in cellen en kijken wat er gebeurt als er meer of minder van is. Ook stoppen we fragmenten uit een ontrafelde vezel in andere cellen om te zien of daar dan snel vezels ontstaan of helemaal niet.’
Oorzaak of gevolg
Wentink maakt ook een kanttekening: ‘Het is niet zeker of de klonterende eiwitvezels oorzaak of gevolg zijn van hersenziekten. Uit hersenonderzoek weten we wel dat ze kenmerkend zijn voor deze ziekten. Bij Alzheimer zijn het vezels van amyloid-bèta en het Tau-eiwit, bij Parkinson α-synucleïne.’ Wentink onderzoekt vezels van dat laatste eiwit, maar de kennis die ze opdoet, is ook relevant voor andere neurodegeneratieve ziekten.
Als blijkt dat de hoeveelheid chaperonne veel uitmaakt voor het ontstaan en verspreiding van de Parkinson-vezels, kan een synthetische chaperonne misschien een medicijn zijn. ‘In het tweede deel van mijn onderzoek gaan we zo’n synthetische chaperonne ontwikkelen’, zegt Wentink. ‘Dat moet een ander molecuul zijn dan Hsp70, want dat doet veel meer in cellen dan alleen deze eiwitvezels uit elkaar halen. We moeten een molecuul hebben dat specifiek deze vezels aanpakt.’
Wat wordt het target van het medicijn?
Misschien ontdekt Wentink dat de negatieve effecten van Hsp-70 in de cel meevallen. ‘Ook zou het kunnen dat dit eiwit niet het enige mechanisme in de cel is dat eiwit vezels afbreekt, maar ook dan zouden we via Hsp70 nog steeds een manier hebben om deze processen te kunnen versnellen. ‘Ons project is een belangrijke stap in het onderzoek naar neurodegeneratieve ziekten. Het helpt om te bepalen op welk target een medicijn moet aangrijpen.’
Onbedoelde eiwitklontering en chaperonne Hsp70
Stel je een eiwitmolecuul voor als een bolletje wol, bestaand uit een ketting van atomen met allerlei lussen erin. Het zit losjes opgerold en beweegt zich in een cel, door een waterige omgeving. Dat gaat het beste als de wateroplosbare of hydrofiele stukjes aan de buitenkant zitten en de hydrofobe, olieachtige gedeelten aan de binnenkant. Is een eiwit niet goed gevouwen, dan komt vrijwel altijd zo’n hydrofoob deel aan de buitenkant terecht. Deze plakkerige oppervlakken kunnen aan elkaar gaan kleven, wat leidt tot eiwitklontering. Komt een chaperonne-eiwit zoals Hsp70 daartegenaan, dan begint het aan de losjes opgerolde kluwen te trekken. Die ontwart, en floept daarna vanzelf alsnog in de juiste 3D-structuur.
Tekst: Rianne Lindhout
Beeld boven artikel: Pixabay
