
Nieuwe techniek geeft chemici ongekende controle in medicijnonderzoek
Leidse chemici hebben een nieuwe techniek ontwikkeld waarmee ze de rol van kinases – een groep eiwitten – kunnen achterhalen in een levende cel. De techniek maakt het eenvoudiger om nieuwe medicijndoelwitten te vinden voor ziektes als kanker en reuma. Het team publiceerde de bevindingen in het vakblad Nature Communications.
Potentiële medicijndoelwitten
De groep van Mario van der Stelt, hoogleraar Moleculaire fysiologie, bestudeert verschillende types eiwitten die betrokken zijn bij ziektes, in de hoop nieuwe medicijndoelwitten te vinden. Voor dit onderzoek keek het team naar kinases: enzymen die andere eiwitten aan- of uitschakelen. Kinases zijn betrokken bij processen zoals signaaloverdracht, celdeling en metabolisme en spelen een rol bij een breed scala aan aandoeningen zoals kanker en ontstekingsziekten.
‘Er zijn meer dan vijfhonderd kinases bij mensen bekend,’ zegt eerste auteur Tom van der Wel. ‘Maar medicijnen die nu op de markt zijn hebben maar een klein deel van die kinases als beoogd doelwit. Die andere kinases hebben potentie als nieuw doelwit.’ Daarvoor moet wel eerst hun rol in het lichaam onderzocht worden. En daar ligt nou net het probleem, vertelt de chemisch bioloog. ‘Ze lijken allemaal erg op elkaar en dat maakt het ingewikkeld om de rol van een individueel kinase vast te leggen. Onze nieuwe methode kan daarbij helpen.’
Een slimme truc
Het Leidse team keek in eerste instantie naar één specifiek kinase, namelijk tyrosine kinase feline sarcoma oncogene, of kortweg FES. De onderzoekers bedachten een slimme truc om de rol van FES vast te stellen.
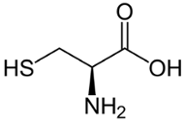
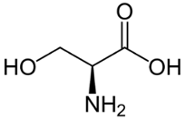
Hiervoor maakten ze gebruik van CRISPR-Cas, een DNA-bewerkingstechniek. Daarmee veranderden de scheikundigen één van de drie miljard baseparen in het menselijk DNA, wat resulteerde in een minuscule aanpassing van FES. Van der Wel: ‘We hebben hiermee in het actieve centrum van het eiwit – de plek waar reacties plaatsvinden – het aminozuur serine veranderd in een cysteïne. Dat komt effectief neer op de vervanging van één zuurstofatoom door één zwavelatoom op een totaal van ruim 13.000 atomen in het eiwit.’ Het zwavelatoom gaat veel sneller een reactie aan en diende daarmee als een soort haakje waaraan de onderzoekers hun chemische gereedschap konden vastmaken.
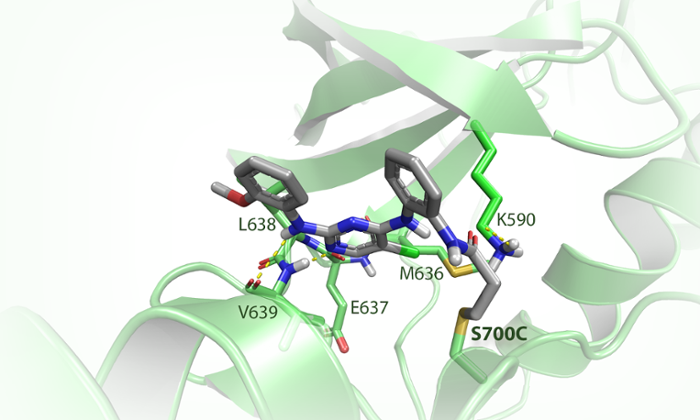
Een zoeklicht
Van der Wel ontwierp vervolgens een fluorescerend molecuul dat specifiek reageerde met het haakje en niet met het oorspronkelijke serine-aminozuur. Dit fluorescerende onderdeel diende vervolgens als een soort zoeklicht, waardoor de chemici precies konden zien wat FES doet in een levende cel. ‘We hebben toen aangetoond dat in het geval van een infectie FES betrokken is bij het “opeten” van bacteriën door cellen van het afweersysteem,’ zegt Van der Wel. ‘Bovendien hebben we ontdekt dat FES een specifiek proces in deze cellen activeert, dat ook een rol speelt in kanker en ontstekingsziekten zoals reuma. Vervolgonderzoek moet uitwijzen of het inactiveren van FES gebruikt kan worden als nieuwe therapeutische aanpak voor deze aandoeningen.’
Toepasbaarheid in het veld
Van der Stelt benadrukt dat de techniek ook toepasbaar is op andere kinases. ‘Daarmee is deze techniek van belang om nieuwe medicijndoelwitten te valideren voor verschillende ziekten.’ Van der Wel legt uit hoe ze daar zijn achtergekomen. ‘We hebben dezelfde truc ook op een aantal andere kinases toegepast, waaronder FER – een kinase dat erg lijkt op FES. Het heeft me veel tijd gekost om deze methode te ontwikkelen, ruim vier jaar. Maar nu kunnen andere wetenschappers deze techniek ook toepassen en daarmee hopelijk bijdragen aan de ontwikkeling van nieuwe medicijnen.’
Publicatie
Tom van der Wel et al. – Chemical genetics strategy to profile kinase target engagement reveals role of FES in neutrophil phagocytosis (2020), Nature Communications
Prijzen
Voor dit onderzoek heeft Van der Wel twee prijzen ontvangen: een publieksprijs op het Chemical Biology symposium in Heidelberg op het EMBL (2018) en de prijs voor beste presentatie op de Dutch Medicines Days 2019 in Leiden. Daarnaast mag hij namens de Koninklijke Nederlandse Chemie Vereniging (KNCV) Nederland vertegenwoordigen in een competitie voor jonge onderzoekers op het congres van de European Federation of Medicinal Chemistry. Het onderzoek is gefinancierd door de topsector Chemie en in samenwerking uitgevoerd met de biotechbedrijven Covalution Biosciences en PamGene.
Tekst: Bryce Benda
