
Nanodeeltjes en licht gaan de strijd aan met kanker
De Leidse promovendus Xuequan Zhou heeft een veelbelovend nieuw molecuul ontworpen dat effectief kankercellen kan bestrijden zonder hierbij ook de gezonde cellen aan te tasten. De truc: het medicijn wordt pas actief als je het bestraalt met licht. Zhou’s nieuwe molecuul is extra efficiënt, aangezien het zelf nanodeeltjes kan vormen. Het onderzoek heeft de cover van het Journal of the American Chemical Society gehaald.
Kanker bestrijden met licht
Gewone antikanker-medicijnen maken vaak te weinig onderscheid tussen de goede en slechte cellen: ze doden ze allebei. Daarom werkt de Bonnet groep van het Leids Instituut voor Chemisch Onderzoek aan moleculen die pas actief worden onder invloed van zichtbaar licht. Hiermee kunnen dokters een specifiek gebied van het lichaam behandelen, zonder de rest te beschadigen. Deze zogeheten fotodynamische therapie wordt momenteel al gebruikt in klinieken.
Een nieuw medicijn
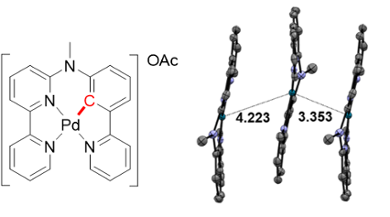
‘De structuur van een molecuul bepaalt zijn fysische, chemische en biologische eigenschappen,’ legt Xuequan Zhou uit. ‘Daarom kan een kleine aanpassing van deze structuur grote gevolgen hebben voor de werking. Ons nieuwe werk is daar een goed voorbeeld van.’ Zhou ontwierp een nieuw en efficiënt antikanker-medicijn door een kleine verandering te maken in een bestaand molecuul: hij verving één stikstofatoom voor een koolstofatoom. Dit resulteerde in een molecuul met een metalen kern van palladium, direct gebonden aan een organisch fragment door middel van een koolstof-palladiumverbinding (figuur 1). Door deze verbinding reageert het molecuul op blauw licht en kan het zeer goed kankercellen doden (zie kader).
Light induced therapy
Xuequan's palladiumcomplex werkt door middel van zogenaamde zuurstofactivering. Bij bestraling met licht raakt het palladiumcomplex in een aangeslagen toestand, oftewel: krijgt het extra energie. Het aangeslagen palladiumcomplex brengt deze lichtenergie over naar een dioxinemolecuul (O2) dat aanwezig is in de bestraalde cel of het bestraalde weefsel. Hierdoor ontstaat een reactieve zuurstofsoort die de kankercel vervolgens doodt.
Zelf-herschikkende moleculen
Naast het fotochemische gedrag, vertoont dit molecuul nog een andere vrij uitzonderlijke eigenschap, vertelt Zhou. ‘Vanwege de lage lading en het hydrofobe organische gedeelte, heeft het molecuul de neiging om zichzelf te herschikken via een proces dat we ‘metallofiele interactie’ noemen: de kernen van palladium houden van elkaar, en proberen daarom dicht bij elkaar te zijn. Wanneer het medicijn oplost in het lichaam, zal het molecuul van Zhou hierdoor zelf nanodeeltjes vormen.
Kankercellen kunnen deze door blauw-licht geactiveerde nanodeeltjes zeer efficiënt absorberen. ‘Normaal gesproken worden deze deeltjes daarom speciaal aan een antikankermedicijn toegevoegd, om te helpen bij het opsporen van de tumor,’ legt begeleider Sylvestre Bonnet uit. ‘Voor het nieuwe molecuul van Zhou is deze stap echter niet meer nodig, omdat het medicijn zijn eigen nanodeeltjes maakt.’
Veelbelovende resultaten
Met de eerste biologische experimenten in Leiden heeft Zhou al aangetoond dat de nanodeeltjes in vitro inderdaad zeer efficiënt kankercellen kunnen doden bij bestraling met blauw licht. Vervolgens toonde hij in samenwerking met professor Wen Sun van de Dalian University of Technology in China aan dat de nanodeeltjes de groei van kanker in muizentumormodellen kunnen remmen. Zhou: 'Al met al suggereren deze resultaten een veelbelovende toekomst voor zelf-herschikkende moleculen als medicijnen tegen kanker, omdat ze tumoren beter kunnen opsporen en dus efficiënter kunnen bestrijden.’
LINK TOEVOEGEN
