
Nieuw antibioticum vernoemd naar Leiden
Toenemende resistentie en een gebrek aan nieuwe antibiotica vormen een groot probleem voor de volksgezondheid. Tegen die achtergrond zoekt Gilles van Wezel van het Instituut Biologie Leiden naar nieuwe medicijnen. Samen met toenmalig promovendus Changsheng Wu en collega’s ontdekte hij het bijzondere antibioticum lugdunomycine, dat ze vernoemden naar Leiden. De ontdekking is onlangs gepubliceerd in het tijdschrift Angewandte Chemie.
Uitgeputte bron
‘De voorspelling is dat in 2050 zo’n 10 miljoen mensen wereldwijd zullen overlijden aan de gevolgen van antibioticaresistentie’, vertelt Van Wezel. ‘Dat is evenveel als door kanker. Er is sprake van een negatieve trend waarbij steeds meer bacteriën resistent worden en vaak tegen meerdere antibiotica, terwijl er tegelijkertijd steeds minder nieuwe medicijnen op de markt komen. Daarvoor willen we oplossingen vinden.’ Van Wezel doet onderzoek naar de bacterie Streptomyces. Dit geslacht leeft in de grond en produceert maar liefst tweederde van alle antibiotica. Omdat ze al zo lang worden gebruikt en gescreend, dacht de farmaceutische industrie dat alles wat er bij deze bacteriën te halen viel, inmiddels wel bekend was. ‘De bron leek uitgeput’, zegt Van Wezel. ‘Maar dat bleek toch niet helemaal het geval.’
Slapend antibioticum
Aan het begin van de 21ste eeuw nam DNA sequencing een enorme vlucht: een techniek om het totale DNA van organismen in beeld te brengen en te analyseren. ‘Zo konden we dus ook het DNA van antibiotica-producerende bacteriën bekijken. Toen bleek dat deze veel meer potentie hadden dan dat wij tot dan toe voor mogelijk hielden!’ De modelstam Streptomyces coelicolor, die hemelsblauwe (coelicolor in het Latijn) antibiotica produceert, is een mooi voorbeeld. De bacterie produceert uitzonderlijk veel, wel vier verschillende soorten. Al vijftig jaar werken duizenden wetenschappers aan deze stam; er werd dan ook gedacht dat er verder niet zoveel meer te halen viel. Toen in 2002 het volledige DNA van de stam werd gepubliceerd, bleek echter dat het DNA van de bacteriën veel meer recepten voor antibiotica bevat dan alleen voor de antibiotica die ze in het laboratorium produceren. Dit worden slapende antibiotica genoemd.
Slapende antibiotica
‘Het kost een bacterie veel energie om antibiotica te maken’, legt Van Wezel uit. ‘Daarom doen ze dat niet zomaar als het niet nodig is.’ In het laboratorium maken bacteriën dus minder antibiotica dan in de bodem. Gewoonweg omdat in het lab de benodigde ecologische condities ontbreken. ‘Of anders gezegd: in de bodem zijn meer vijanden waartegen bacteriën die antibiotica nodig hebben’.
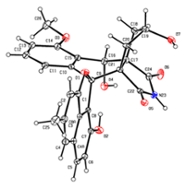
Leids antibioticum
Het antibioticum dat Wu, Van Wezel en co-promotor Young Hae Choi ontdekten is ook zo’n slapend antibioticum, geproduceerd door een nog onbekende Streptomyces bacterie uit het Qinling gebergte in China. Ze noemden het lugdunomycine, naar de Latijnse naam voor Leiden (Lugdunum batavorum). ‘Wu heeft gekeken naar een stam die op het oog niks produceerde. Maar na het nabootsen van verschillende groeiomstandigheden, zagen we hier toch biologische activiteit. Dat heeft geleid tot de ontdekking van een chemisch molecuul met onvoorzien complexe structuur!’ Lugdunomycine is afgeleid van een bekende familie van moleculen met vooral anti-tumor activiteit, maar onderging zulke grote aanpassingen dat het er niet meer op lijkt. ‘Een soort helikopter door toevoeging van drie extra ringen,’ aldus Van Wezel. 'We hebben dit nog nooit eerder gezien, maar het zal zeker vaker voorkomen in de natuur. Maar dan in dusdanig kleine hoeveelheden dat men dit tot nu gemist moet hebben.’
Nieuw medicijn?
De ontdekking van zo’n radicaal andere chemische structuur is zeldzaam. Nu Wu, Choi en Van Wezel de structuur van lugdunomycine hebben gepubliceerd, volgt de volgende uitdaging: zorgen dat de Streptomyces bacterie er meer van gaat produceren. Ook moeten ze onderzoeken wat de activiteit van het molecuul precies is, en of deze ook daadwerkelijk klinisch toepasbaar is. Mogelijk kan het Leidse antibioticum in de toekomst wel als echt medicijn dienen. Hiervoor startte Van Wezel een vervolgproject binnen het NACTAR-programma in het NWO-domein Toegepaste en Technische Wetenschappen (TTW). In dit programma werken wetenschappers en het bedrijfsleven samen aan de ontwikkeling van nieuwe antibiotica. ‘Voor nu hebben we in ieder geval dit molecuul ontdekt en dat is heel spannend. Ik denk niet dat we zo 1, 2, 3 nog eens een molecuul met zo’n structuur zullen ontdekken.’
Omslagfoto: Voedingsbodem met een producersstam van Streptomyces samen met de opname van een enkele kolonie (Gilles van Wezel)
Tekst: Hilde Pracht
NACTAR
Binnen het NACTAR-programma werken bijna vijftig wetenschappers en twintig bedrijven samen aan de ontwikkeling van nieuwe toegankelijke en betaalbare antibiotica, en alternatieven voor antibioticagebruik. Voor de verdere ontwikkeling van lugdunomycine kreeg Van Wezel financiële bijdragen van Pfizer, Batavia Biosciences (Leiden) en Fundacion Medina (Granada, Spanje), een spin-off van Merck. Het project is een samenwerking met de groep van professor Adri Minnard in Groningen
Lees meer over het NACTAR-programma op de website van NWO: Wetenschap en bedrijfsleven werken samen aan betaalbare alternatieven voor antibiotica.
Eerder verscheen op deze site een artikel over het opzetten van NACTAR: Met 6 miljoen vaart achter zoektocht naar nieuwe antibiotica
