Hoefijzervormige ‘Parkinsoneiwitten’ vormen klonten
Er is weer nieuws over het eiwit alpha-Synucleine. dat een belangrijke rol wordt toegedicht bij de ziekte van Parkinson. Biofysicus Martina Huber e.a. laten zien op welke manier deze eiwiten samenklonteren als ze met een membraan in contact komen. Hun artikel in de Journal of the American Chemical Society (JACS) staat vanaf 3 maart online.
Plaques
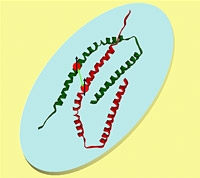
De ziekte van Parkinson wordt gekenmerkt door ophopingen van eiwitten in de hersenen, plaques genoemd. Het hoofdbestanddeel van deze plaques is het eiwit alpha-Synucleine, kortweg αS. ‘Maar welke rol het eiwit in de hersens speelt is nog niet duidelijk,’ zegt Huber. Ook over de functie van de plaques verschillen de wetenschappers nog van mening.
Binding aan membraan
Wel zijn ze het er over eens dat interactie met zenuwmembranen van belang is voor de biologische werking van αS, en daarmee misschien ook voor de ontwikkeling van Parkinson. Eerder toonden Huber en haar collega’s al aan dat het normaal ongestructureerde eiwit, met 140 aminozuren relatief klein, bij binding aan een membraan plotsklaps een duidelijke vorm aanneemt. Twee stukjes ervan draaien tot een kurkentrekkervorm, de zogenoemde a- helix, ertussenin blijft een deel zoals het was. Zo bindt het uiteindelijk in de vorm van een hoefijzer aan het membraan.
Samenklontering
Nu laten de onderzoekers in het Journal of the American Chemical Society (JACS) zien dat αS niet alleen van structuur verandert, maar ook dat meerdere van deze eiwitten samenklonteren bij interactie met een membraan. Een gedetailleerd model laat zien hoe de wisselwerking tussen de eiwitten onderling is. ‘Dit is misschien ook een van de redenen waarom αS die hoefijzervorm aanneemt,’ vertelt de Leidse biofysicus. ‘Een opstaande kant van het hoefijzer kan gemakkelijk de ruimte tussen twee opstaande kanten van een ander hoefijzer opvullen. Op die manier ontstaat een stabiel aggregaat van αS-moleculen.’
Unieke techniek
Het bestaan van eiwitaggregaten is geen nieuws. Maar tot op heden bestond er nog geen manier om te kunnen bepalen hoe die precies in elkaar zitten. De techniek die de Leidse biofysici hiervoor gebruiken, gepulste elektronspinresonantie (ESR) is uniek in Nederland en door de jaren heen verder ontwikkeld. ‘Hiermee kunnen we interacties tussen eiwitten op zeer kleine schaal en ook nog eens bijzonder specifiek bekijken. Zonder deze techniek was het nooit gelukt om het model te ontwikkelen.’
Patiënten
Wanneer het onderzoek ook echt iets kan gaan betekenen voor Parkinsonpatiënten? ‘Daar waag ik mij niet aan,’ aldus Huber. ‘Laten we eerst maar eens gaan kijken onder welke specifieke omstandigheden de door ons aangetoonde interacties plaatsvinden. Daar hebben we vooralsnog onze handen wel vol aan.’
Samenwerking en financiering
Het onderzoek is een samenwerking van de ESR-groep in Leiden met de groep van Vinod Subramaniam van de Universiteit Twente, en wordt mede gefinancierd door de Stichting voor Fundamenteel Onderzoek der Materie (FOM) en de Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO).
"A stable lipid-induced aggregate of alpha-Synuclein"
Author(s): Drescher, Malte; van Rooijen, Bart; Veldhuis, Gertjan; Subramaniam, Vinod; Huber, Martina, Journal of the American Chemical Society (JACS) 3 maart 2010.
Links
- Parkinson op de kubieke nanometer (Universitaire Nieuwsbrief 30 september 2008)
- Bioscience: The Science base of Health is een van de onderzoeksprofileringsgebieden van de Universiteit Leiden
- Natuurkunde studeren in Leiden
- Ben je middelbare scholier (3e -6e klas) en geïnteresseerd in natuurkunde én in gezondheid? Kom naar de Oriëntatiedag van de Universiteit Leiden op 13 maart
- Voor natuurkundestudenten: - Verder in de biofysica? Master of science in Physics Voorlichtingsdag: 18 mei 2010
