
Moleculair mysterie in de ruimte
Tussen de sterren is niet alleen leegte. Er zweven ook stoffen als methanol en koolstofdioxide. Chemische theorieën kunnen nog niet verklaren hoe die zijn ontstaan onder omstandigheden die dat juist onmogelijk zouden moeten maken. Fedor Goumans gaat met een Veni-beurs proberen die vraag te beantwoorden.
IJler dan lucht

Energie
Reactiebarrière

‘Van koolstofmonoxide weten we hoe het ontstaat, daar hebben we althans een plausibele verklaring voor’, vertelt Goumans. ‘Maar bij koolstofdioxide en methanol is er een probleem. Voor het vormen van die moleculen is er een reactiebarrière.’ Die barrière is een soort weerstand die de atomen moeten overwinnen, voordat ze met elkaar kunnen reageren, net zoals je bij een klemmende deur eerst veel kracht moet zetten voordat hij opengaat. Normaal wordt die barrière overwonnen omdat de moleculen snel genoeg bewegen (dat wil zeggen dat de temperatuur hoog genoeg is) en de botsing daardoor voldoende energie oplevert voor de reactie. Maar de gebieden in het heelal waar moleculen ontstaan zijn daar veel te koud voor: de temperatuur ligt daar rond de 260 graden onder nul. Dat betekent dat de atomen niet snel genoeg bewegen om de reactiebarrière te overwinnen.
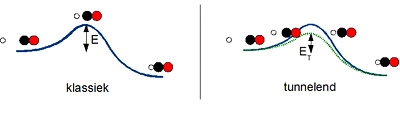
Tunnelen
Hoe kunnen die reacties dan toch plaatsvinden? Goumans: ‘Een mogelijkheid, of eigenlijk dé mogelijkheid, is dat het waterstofatoom tunnelt door de barrière. Als een deeltje ‘tunnelt’ is het alsof het op een magische manier van de ene kant naar de andere kant van een hindernis wordt getransporteerd, zonder ‘door’ de hindernis heen te gaan. Het is alsof je in je kelder was en ineens op zolder staat, zonder dat de kelderdeur open is gegaan of dat je hebt moeten lopen. Waterstofatomen zijn licht genoeg om een beetje te tunnelen, en daarmee ineens een klein stapje te maken om aan de andere kant van de reactiebarrière terecht te komen, waardoor de reactie sneller gaat dan je zou verwachten. Misschien dat dat tunnelen ervoor zorgt dat er een waterstofatoom zich vast kan maken aan koolstofmonoxide als eerste stap in de methanolvorming.’
Ruimtemethanol
Toch kunnen onderzoekers nog niet alles verklaren. Goumans: ‘Je kunt de berekeningen controleren door te kijken naar de verhouding tussen normaal waterstof en zware waterstofatomen (deuterium) in bijvoorbeeld methanol in de ruimte. Waterstofatomen zijn lichter dan deuteriumatomen, dus ze tunnelen beter, en je zou dus verwachten dat het ruimtemethanol relatief meer waterstofatomen en minder deuteriumatomen bevat dan de rest van de ruimte. Maar het is juist andersom. Er spelen waarschijnlijk dus nog meer reacties mee.’ Het stofdeeltje waarop de reacties plaatsvinden zou die bijvoorbeeld ook kunnen beïnvloeden, Goumans hoopt bij een bezoek in Duitsland uit te zoeken hoe de simulatie van de reacties aan de simulatie van een stofdeeltje gekoppeld kan worden.
Fosteriet
Er lijkt nog voldoende te doen, maar wat drijft Goumans? ‘Het leuke aan onderzoek vind ik de dingen die je niet verwacht, je denkt zus, maar het is zó. Tijdens mijn onderzoek in Londen bijvoorbeeld bestudeerde ik het mineraal fosteriet, en er kwam uit onze berekeningen dat waterstof dat zich daaraan bond, zich opsplitste waarbij de kern aan een zuurstofatoom bond en het elektron naar het magnesium-ion ging. En toen we een verwant mineraal (magnesiumoxide) gingen bestuderen bleek dat vreemde mechanisme inderdaad te bestaan. Als je berekeningen doet en er komt uit wat je al had verwacht, of een beetje meer, of een beetje minder, dat is ook maar zo saai, toch?’
(16 juni 2009/Eric-Wubbo Lameijer)
